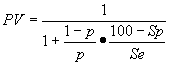 , где PV – вероятность заболевания после проведения диагностического теста, р – вероятность заболевания на основании симптомов (до проведения данного теста), Se – чувствительность и Sp-специфичность теста.
, где PV – вероятность заболевания после проведения диагностического теста, р – вероятность заболевания на основании симптомов (до проведения данного теста), Se – чувствительность и Sp-специфичность теста.ПОЧЕМУ МЫ НАЧИНАЕМ ГОВОРИТЬ О НАУЧНО-ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЕ?
С.Л.Плавинский.
Кафедра педагогики высшей медицинской школы и философии СПб МАПО
Сегодня может сложиться впечатление, что весь мир внезапно начал говорить о научно-доказательной медицине и оценке технологий в области здравоохранения. Начали издаваться журналы, посвященные научно-доказательной медицине, на медицинских Интернет-сайтах появились такие разделы, как "Научно-доказательная кардиология" и "Научно-доказательная онкология", вокруг терминов идут жаркие споры, а фармацевтические компании начинают организовывать
семинары на тему "Научно-доказательная медицина против врачебных рекомендаций" (на которых они "научно" доказывают неправильность рекомендаций, не включающих в схему лечения их последние, наиболее дорогостоящие препараты). В пылу всей этой активности хочется, перефразируя М.Жванецкого спросить "Научно-доказательная медицина это что-то новое или то, чем мы уже давно занимались?" Ответ на этот вопрос зависит от того, как мы определим термин научно-доказательная медицина и посмотрим на то, почему именно сейчас разговоры на эту тему стали столь популярны. Термин "научно-доказательная медицина" (НДМ) был введен в практику специалистами из университета Мак-Мастера (Канада) как интегрирование наилучших научных данных с клиническим опытом и ценностями пациента (D.Sackett et. al, 2000). Иными словами, может показаться, что это не что иное, как "внедрение научных результатов в клиническую практику". Итак НДМ это новое обозначение для того, чем все уже давно занимались? И да, и нет. НДМ предлагает иной взгляд на проблему внедрения научных исследований в клиническую практику. НДМ предложила использовать научный подход к оценке научных публикаций. Ее сторонники подняли вопрос, а а основании каких фактов мы считаем, что данный препарат лучше другого; почему надо применять именно этот, а не тот диагностический тест, и т.д. В целом они призвали врачей не просто внедрять научные исследования в практику, а критически оценивать те сведения, которые им предлагаются.Почему же данный призыв появился именно сейчас, и именно сейчас весь мир как будто по-новому стал смотреть на результаты научных исследований. Любое движение не появляется само по себе. Роль материального базиса для взрывного развития НДМ сыграло широкое распространение компьютерной техники, библиографических баз данных и Интернета, который позволяет получать практически мгновенный доступ к интересующим нас научным данным. Однако технический прогресс явился необходимым, но не достаточным фактором появления НДМ. Значительно большую роль сыграли иные факторы, которые обеспечили усиление важности научных исследований в клинической практике.
Во-первых изменение структуры заболеваемости в пользу хронических заболеваний привело к тому, что длительность многих заболеваний стала сравнима со временем активной рабочей деятельности врача. Действительно, средняя продолжительность предстоящей жизни пациента с ИБС может составлять от 17 до 24 лет (Плавинская С. и соавт., 1997, Garber A, Solomon N., 1999), а за это время врач может отойти от активной клинической практики, сменить место
работы и по иным причинам потерять контакт с пациентом. Если выразить эту мысль более жестко, в настоящее время врач, который ставит диагноз в принципе фатального заболевания не пишет заключение о смерти. Все это приводит к тому, что врач теряет четкие ориентиры, базируясь на которых он мог бы сказать, что назначенная им терапия приводит к улучшению прогноза для больного. В отношении терапии врач становится все более и более зависимым от вторичных источников информации, научных публикаций, которые преодолевают проблемы одновременным наблюдением за большим количеством пациентов и длительными сроками исследования.Во-вторых лекарственная терапия и диагностика стали большим, много миллиардным бизнесом. Разработка новых лекарственных средств превратилась в высокозатратное и опасное предприятие. Вложение средств в разработку лекарства, которое оказывается неэффективным может обанкротить даже крупную корпорацию. Поэтому фармацевтичекие фирмы стараются "выжать" из препаратов все, что только можно. Проводится агрессивная рекламная политика, специалисты по маркетингу стремятся представить лекарство в наиболее выгодном свете, используя для этого все новейшие разработки и психологические уловки. Врачи и медицинский персонал стали мишенью наиболее интересной в истории бизнеса рекламной компании - компании в которой целевой аудиторией являются люди, принимающие решение о покупке, но не финансирующие ее из собственного кармана.
В-третьих пациенты стали значительно более образованными. Медицинский персонал, осуществляющий уход за пациентом, перестал быть единственным источником информации для него и его семьи. Журналы, газеты, телевидение, Интернет - все уделяют огромное внимание вопросам здоровья и лечению. Показательным является то, что статья о положительном эффекте профилактики производными фибровой кислоты ИБС (Helsinki Heart Study) появилась в The New-York Times в один день с публикацией результатов исследования в New England Journal of Medicine (что означает, что журналисты ознакомились с результатами до их официальной публикации). Средства массовой информации оказывают значительное влияние на восприятие пациентами назначаемого лечения и согласия их с терапией. Как указывал T.Shepherd, после публикации в США в журнале Atlantic Monthly статьи "Мифы о холестерине", которая
критически оценивала возможности профилактики ИБС путем снижения уровня холестерина, большая группа пациентов уже согласившихся участвовать в исследовании по первичной профилактике с использованием правастатина (WOSCOP) аннулировала свое согласие. И уж конечно сложно переоценить опасность ситуации в которй пациент просит врача назначить лекарство о котором пациент уже нашел информацию, а врач не имел такой возможности или времени.Предшествующий пункт тесно связан с четвертой причиной появления НДМ - общей гуманизацией общества, акцентом на самостоятельность и самодостаточность личности. Необходимость получения информированного согласия на лечение предполагает, что врач предлагает пациенту информацию и помогает ему критически оценить ее. Вместе с тем и для самого врача становится все более и более важным самосовершенствование, которое должно базироваться на самостоятельном поиске новой информации, ее критической оценке и внедрении в практику. Не случайно НДМ появилась в университете Мак-Мастера, который еще в конце 60х годов рискнул полностью перестроить обучение на медицинском факультете так, чтобы усилить самостоятельную работу студентов через внедрение проблемно-ориентированного обучения.
D.Sackett и соавт., базируясь на большом числе исследований, добавляют еще несколько причин, приведших к распространению НДМ:
1. Ежедневная потребность в новой, достоверной информации о диагностике, прогнозе, лечении и профилактике (до пяти раз на одного госпитализированного пациента и до двух раз на каждые три случая при амбулаторном приеме)
2. Неадекватность традиционных источников информации, поскольку они быстро устаревают (учебники), часто неправы (эксперты), неэффективны (традиционная система последипломного образования) или чресчур объемны и не всегда полностью достоверны (медицинские журналы)
3. Расхождение между диагностическими навыками и клиническим мышлением, которые приходят с опытом, и знаниями и работоспособностью, которые со временем снижаются
4. Невозможностью для врача позволить более, чем несколько секунд для нахождения и переработки данных для каждого пациента или выделить более, чем полчаса в неделю для чтения специальной литературы
Почему же необходимо начать научный анализ научных публикаций? Неужели нельзя положиться на мнение экспертов? Ответ на этот вопрос был получен в нескольких сериях исследований. Когда четырем кардиологам были представлены высококачественные ангиограммы и их попросили оценить, превышает ли стеноз проксимального и дистального сегмента левой передней нисходящей артерии 50%, по поводу 60% пациентов их мнения разошлись (Zir et al., 1976). В другом исследовании изучалось как часто эксперты меняют свое мнение, если им представлены одни и те же ангиограммы. Мнения менялись в 8%-37% случаев, в зависимости от расположения сегмента – чем дистальнее располагался сегмент, тем больше расхождений было в оценках (Eddy, 1984). Естественно, что ошибаться может любой специалист, но поиск доказательств позволяет снизить вероятность чужих ошибок при принятии терапевтических решений.
Таким образом можно считать, что появление НДМ явилось результатом закономерного развития науки и клинической практики и общих тенденций развития общества.
В целом процесс, описываемый НДМ включает несколько этапов.
1. Формулировка клинического вопроса (Какая информация мне необходима?)
2. Поиск данных
3. Критическая оценка данных
4. Внедрение в практику
5. Оценка эффекта
За каждым из этих этапов стоит определенный набор правил и методов, а также знаний, которые необходимо использовать.
Так, формулировка клинического вопроса, позволяет структурировать проблему, с которой сталкивается врач. В принципе данные, которые интересуют врача при формулировке вопроса, могут быть отнесены к одной из четырех категорий: диагностика, лечение, этиология и прогноз. Каждая из них будет требовать поиска определенных типов исследований и своего подхода при критической оценке найденной информации. При этом каждая категория имеет свой "золотой стандарт" в области исследований, с которых и следует начинать поиск. Так, прогноз и этиологические факторы лучше всего оценивать по результатам проспективных когортных исследований. Диагностическая значимость тестов определяется на основе исследований типа случай-контроль, а терапевтические вмешательства лучше всего изучаются в рамках рандомизированных, контролируемых клинических исследований.
Вопросы, в свою очередь, могут быть разделены на два основных класса - "общие" и "частные". "Общие" вопросы обычно касаются этиологии и патогенеза заболевания, а также его клинических проявлений. "Частные" вопросы фокусируются на конкретной проблеме, связанной с ведением пациента. Они обычно включают следующие компоненты: характеристики пациента, особенности его состояния, сравнение тактик ведения и желаемый результат лечения. (Приведет ли у пожилого пациента с сердечной недостаточностью и мерцательной аритмией добавление аспирина к стандартной терапии ингибиторами АПФ и диуретиками к снижению смертности?) По мере накопления клинического опыта врач все больше интересуется "частными" вопросами, однако любой новый пациент может потребовать ответа на "общие" вопросы.
После того, как вопрос был сформулирован, необходимо найти на него ответ. При этом возможны два режима поиска - оригинальных исследований и прошедших методический отбор и опубликованных в журналах и компьютерных базах НДМ. Оба этих режима имеют свои плюсы и минусы. Поиск в базах, предназначенных для НДМ (ACP Journal Club, Cochrane Collaboration Data Base, другие журналы и журнальные секции, посвященные НДМ) обычно значительно проще, иногда позволяет найти данные, отсутствующие в других источниках и структурированность источников облегчает их критическую оценку. Негативная сторона включает их неполноту (отсутствие систематического обзора по данной теме отнюдь не означает, что работа в этой области не проводилась
), меньшую доступность (в сравнении с Medline), сложность найти работу, соответствующую конкретному пациенту и тот факт, что данные могут устареть к моменту публикации. Поиск оригинальных данных (базы Medline, EMBASE, "Российская медицина") позволяет найти самые свежие исследования, сформулировать запрос таким образом, что будут выявлены работы, наиболее точно отвечающие на клинический вопрос, предлагает достаточно высокую доступность библиографических баз и позволяет врачу получить собственное представление о материале. Негативной стороной является значительно большие затраты времени на обучение поиску, большие объемы материала, который необходимо просмотреть (при недостаточно специфичном запросе) и возможность потери информации. Используемая стратегия должна зависеть от того, как сформулирован вопрос. Ответы на "общие" вопросы лучше искать в базах данных НДМ, тогда как "частные" вопросы больше приспособлены для запроса к базе библиографических данных общего назначения. Однако в любом случае врач должен быть готов переключаться между режимами поиска.После нахождения данных следует самый ответственный этап НДМ - критическая оценка результатов. Надо подчеркнуть, что критической оценке должны подвергаться все найденные источники - вне зависимости от того, были они получены из базы данных НДМ или найдены в распространяемой фармацевтической компанией публикации. Сразу следует оговориться, что критическая оценка не имеет ничего общего с критиканством или научным нигилизмом, когда результаты исследования не признаются только потому, что человек, просматривающй работу считает, что научные исследования в принципе не могут дать правильных результатов или начинается сознательный (и односторонний) поиск недостатков, если работа противоречит его точке зрения. В принципе критическая оценка означает, что к найденным данным применяется стандартный набор критериев, который оценивает методическое качество исследования. Именно поэтому предлагается вначале проанализировать методический раздел работы, составив представление о качестве исследования (поскольку рецензент не видел выводы, полученные в ходе исследования, его согласие или несогласие с ними не влияет на оценку качества работы) и лишь потом анализировать полученные результаты.
Для иллюстрации хода оценки различных работ приводятся критерии, предложенные D.Sackett и соавт.:
Диагностика
1. Имелось ли независимое сравнение с "золотым стандартом" диагностики?
2. Оценивался ли диагностический тест на адекватной группе пациентов (такой же, с которой приходится сталкиваться в практике)?
3. Проводилось ли сравнение со стандартом вне зависимости от результатов теста?
4. Был ли тест проверен на другой группе пациентов?
Этиология
1. Были ли анализируемые группы аналогичны во всем, кроме интересующего нас воздействия (этиологического агента)?
2. Измерялись ли воздействие и его результаты одинаково во всех группах?
3. Было ли наблюдение за пациентами достаточно длительным, а потери при наблюдении минимальными?
4. Может ли считаться этиологический агент причиной данного заболевания?
Следует отметить, что исследования побочных эффектов лекарственных средств оцениваются так же, как и исследования этиологии.
Терапия
1. Имелась ли группа контроля?
2. Был ли отбор пациентов в группы лечения контроля случайным?
3. Было ли наблюдение достаточно длительным, а потери при наблюдении сведены до минимума?
4. Все ли пациенты анализировались в тех группах, в которые они были первоначально отнесены?
5. Знали ли пациенты и их лечащие врачи о том, в какую группу включен пациент?
6. Получали ли группы одинаковое лечение (за исключением изучаемого препарата)?
7. Были ли группы одинаковыми в начале исследования?
Прогноз
1. Была ли репрезентативная группа пациентов отобрана вскоре после начала заболевания?
2. Было ли наблюдение достаточно длительным, а потери при наблюдении сведены до минимума?
3. Применялись ли объективные критерии оценки исхода?
4. Если были выявлены подгруппы с отличающимся прогнозом, проводилась ли коррекция по основным факторам риска?
5. Проводилась ли проверка полученных данных на другой группе пациентов?
Аналогичные правила критической оценки существуют и для клинических рекомендаций, результатов экономического анализа и статей, посвященных теории принятия решений в медицине.
Следует подчеркнуть, что мы живем в реальном мире. И в этом мире не всегда доступны наилучшие из возможных доказательств. Поэтому НДМ предлагает использовать наилучшие из доступных доказательств. Если найденная работа не отвечает полностью описанным выше критериям, а работы выполненной на более высоком методическом уровне нет, следует воспользоваться теми данными, которые удалось найти. При этом, однако, следует помнить, что вероятность ошибки в такой работе выше, чем в методически более совершенной
.После того, как работа была критически оценена, необходимо ответить на следующий важнейший вопрос - а применимы ли описанные результаты в конкретном случае, который явился причиной формулировки клинического вопроса. Прекрасная с методической точки зрения статья, описывающая особенности лечения артериальной гипертензии у пожилых женщин вряд ли поможет подобрать адекватную терапию молодому мужчине.
Вот именно на этом этапе - применении результатов научного исследования для лечения конкретного пациента и находится основные особенности НДМ. Во-первых, в рамках НДМ большое внимание уделяется тому, каков эффект от использования данного лечения - сможет ли данный конкретный больной ощутить пользу от врачебного вмешательства (размер эффекта). Во-вторых, насколько значим данный эффект для больного - является ли измеренный в исследовании исход именно тем, который врач стремится предотвратить. В этой связи в НДМ достаточно много внимания уделяется истинным и суррогатным исходам. Под суррогатными исходами понимаются те физиологические или биохимические показатели, которые являются факторами риска развития истинных исходов. Так, ни один пациент не может жаловаться на наличие у него повышенного уровня холестерина (поскольку само по себе это состояние бессимптомно), однако повышенный уровень холестерина является фактором риска смерти от ИБС. Поэтому исследование, которое изучает эффективность гиполипидемической терапии, измеряя снижение уровня холестерина, использует суррогатные характеристики исхода. Такие исследования не дают врачу интересующей его информации, которую можно было бы использовать для лечения пациента (поскольку суррогатные исходы могут и не коррелировать с истинными).
Хотя для полноценной работы в области НДМ необходимо располагать достаточными знаниями статистики и клинической эпидемиологии, многого можно добиться и используя лишь небольшой набор правил и показателей.
При ответе на вопрос о способах диагностики следует попытаться получить информацию об операционных характеристиках тестов (чувствительности и специфичности), а также априорной вероятности данного заболевания у обследуемого. Эти сведения позволят определить эффективность назначения диагностического теста. Если не учитывать эти показатели, то наше восприятие может сыграть с нами злую шутку. Попробуйте, например, ответить на следующий вопрос: для исключения относительно редкого, но серьезного заболевания был назначен тест, имеющий чувствительность 80% и специфичность 80%. Учитывая имеющиеся у пациента симптомы, вероятность наличия заболевания составляет примерно 1 к 100. Тест дает положительный результат. Повторное назначение того же теста также дает положительный результат. Какова вероятность, что у этого пациента имеется заболевание? Если не учитывать эти показатели, то наше восприятие может сыграть с нами злую шутку. Попробуйте, например, ответить на следующий вопрос: для исключения относительно редкого, но серьезного заболевания был назначен тест, имеющий чувствительность 80% и специфичность 80%. Учитывая имеющиеся у пациента симптомы, вероятность наличия заболевания составляет примерно 1 к 100. Тест дает положительный результат. Повторное назначение того же теста также дает положительный результат. Какова вероятность, что у этого пациента имеется заболевание? Ответ на этот вопрос дает теорема Байеса. В применении к диагностическим тестам она может быть представлена в следующем виде:
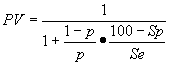 , где PV – вероятность заболевания после проведения диагностического теста, р – вероятность заболевания на основании симптомов (до проведения данного теста), Se – чувствительность и Sp-специфичность теста.
, где PV – вероятность заболевания после проведения диагностического теста, р – вероятность заболевания на основании симптомов (до проведения данного теста), Se – чувствительность и Sp-специфичность теста.
Подставляя описанные выше данные в эту формулу получаем, что после первого тестирования вероятность заболевания составит:
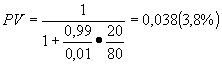
После второго тестирования получаем (используя в качестве исходной вероятности заболевания 3,8%)
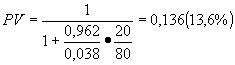
Методики расчета ответа на этот вопрос были описаны в десятках, а то и сотнях публикаций в медицинских журналах во всем мире, однако не менее 20% врачей продолжает давать неправильный ответ. Этот пример, взятый из работы Eddy (1990) показывает, что после получения доказательств их необходимо применить к конкретной ситуации используя также строгую методику.
В данной ситуации подбор теста оказался не очень удачным. Если бы исследователь выбрал тест, обладающий более низкой чувствительностью (например, 60%) и значительно более высокой специфичностью (99%), то, практически ничего не теряя с точки зрения исходной задачи (исключить заболевание), после того, как тест два раза даст положительный результат, диагноз заболевания можно было бы считать подтвержденным (вероятность его наличия составила бы 97.3%). Таким образом, комбинирование знаний клинической эпидемиологии с анализом литературы в рамках НДМ позволяет отбирать наиболее адекватные диагностические методики, снижая вероятность диагностических ошибок.
При анализе исследований лечения надо попытаться определить размер эффекта от применения данного препарата. При этом врача будет интересовать не только и не столько средний размер эффекта, полученный в исследовании, сколько его 95% доверительный интервал. Этот интервал указывает те пределы, в которых может эффект от лечения у данного пациента.
Среди показателей размера эффекта принято выделять три основных индекса: стандартизованный размер эффекта (применяется для оценки количественных показателей исхода), отношение риска/ шансов и показатели снижения риска (абсолютное снижение риска и количество лиц, которое необходимо
лечить).Первый показатель определяется как разность между средними в группе лечения и группе контроля деленная на стандартное отклонение. Иными словами это ответ на вопрос, на сколько стандартных отклонений (или на какую долю его) препарат изменяет показатели, характеризующие состояние больного. Согласно Cohen (1988) если размер эффекта не превышает 0,2, говорят о слабом эффекте терапии, если он оказывается равным 0,5 - говорят об эффекте средней силы и если он превышает 0,8 - то говорят о большом эффекте действия препарата. Знание размера эффекта позволяет оценить действие препарата на группах, которые отличаются от той, на которой была выполнена работа. Например, если в исследовании было выяснено, что уровень артериального давления снизился со 200 до 170 мм. рт. ст. при том, что стандартное отклонение составило 30 мм. рт. ст., то размер эффекта составит (200-170)/30=1. Если попытаться применить препарат на группе лиц с умеренной гипертензией - средним САД 150 мм. рт. ст. и стандартным отклонением 10 мм. рт. ст. тот же препарат будет приводить к снижению, в среднем, на 10 мм. рт. ст. - со 150 до 140 мм. рт. ст.
Отношение шансов (odds ratio) хорошо знакомо игрокам. Под шансом (odds) мы обычно понимаем отношение вероятности выигрыша к вероятности проигрыша или отношения числа раз, когда мы выиграли к числу раз когда мы проиграли. В ситуации клинического (или эпидемиологического) исследования смерть является проигрышем, а жизнь – выигрышем. Тогда шанс смерти для контрольной или экспериментальной группы будет определяться отношением умерших к числу оставшихся в живых к концу исследования. Отношение этих двух шансов (шанс смерти в экспериментальной группе деленный на шанс смерти в контроле) и называется отношением шансов.
Относительный риск будет определяться как отношение вероятности наступления события в экспериментальной группе к его вероятности в контроле. Вероятность отличается от шансов тем, что в знаменателе стоит не число людей, у которых событие не наступило, а общее количество лиц, находившихся в данной группе. Проблема заключается в том, что относительный риск можно определять только в проспективных исследованиях и их достаточно сложно анализировать суммарно. Еще одна проблема с относительным риском проявляется при рассмотрении редких. Предположим, что
в группе контроля умерло 2 человека из 100, а в группе лечения - 1 человек из 100. Отношение шансов смерти составит (1/99)/(2/98)=0,49. Отношение шансов дожить до конца исследования составит 2,02 - или величину, обратную, отношению шансов умереть. Относительный риск смерти составит (1/100)/(2/100)=0,5, а вот относительный "риск" остаться в живых будет составлять (99/100)/(98/100)= 1,01. Иными словами получается, что риск смерти в два раза ниже, а вот вероятность дожить до конца исследования практически одинаковая. Хотя никакого логического противоречия здесь нет, разный результат при использовании одних и тех же данных затрудняет толкование результатов. Поэтому относительный риск является менее распространенным показателем, чем отношение шансов. Более того, в случае редких исходов (вероятность которых менее 10%) отношение шансов, как видно из предыдущего примера, является хорошей аппроксимацией относительного риска.У отношения шансов и относительного риска есть один общий недостаток - как все относительные величины они ничего не говорят об исходной вероятности наступления события. Иными словами препарат, который понижает смертность со 100% до 50% дает такое же отношение шансов и относительный риск, как и препарат, снижающий смертность с 2% до 1%. Поэтому было предложено использовать несколько показателей, опирающихся на абсолютные характеристики риска (Laupacis et al., 1988). Одним из них является снижение абсолютного риска. Как видно из вышеприведенного примера, снижение абсолютного риска составит 50% в первом случае и 1% - во втором.. С целью увеличения наглядности было предложено брать величину, обратную снижению абсолютного риска. Эта величина соответствует числу больных, которых необходимо лечить для того, чтобы предотвратить один случай смерти или осложнения (NNT – number needed to treat). Легко показать, что для первого случая из нашего примера необходимо лечить двух человек, чтобы предотвратить одну смерть (100%/50%=2), а во втором необходимо лечить сто человек (100%/1%=100), чтобы предотвратить одну смерть. Если продолжить эту идею, то можно сказать, что в первом случае «без толку» будет лечиться только один пациент, а во втором – 99.
Показатели количества больных, которых необходимо лечить для того, чтобы предотвратить один случай стали очень распространены в литературе, посвященной НДМ, и ими пользуются как одним из основных инструментов при сравнении разных терапевтических вмешательств. Однако следует помнить, что NNT очень сильно зависит от изучаемой популяции и патологии, а потому могут иногда вводить в заблуждение (Smeeth et al., 1999).
Итак, врач сумел найти интересующую его информацию о методе лечения, выбрать наиболее адекватный с его точки зрения препарат, который обеспечивает NNT около 20. Что теперь? Если бы NNT равнялось 1, т.е. каждый пролеченный больной испытывал бы положительный эффект от терапии, то назначение такого лечения было бы полностью оправдано. А как же быть в данном случае? Сравнивая этот препарат с другими, можно сказать, что он достаточно эффективен, но захочет ли пациент пойти на дополнительные расходы и неудобства связанные с приемом этого препарата, если не будет уверен в положительном результате лечения? Вот на этом этапе и наступает время синтезировать полученные результаты с предпочтениями и ценностями пациента. Наступает
время для клинического анализа принятия решений (КАПР).Данный раздел клинической эпидемиологии и НДМ заслуживает отдельного обсуждения ввиду своей важности. Следует только упомянуть, что при принятии решения могут учитываться различные параметры – клиническая эффективность, побочные эффекты, стоимость, предпочтения пациента и многое другое. Существует достаточно много методик КАПР – деревья решений (Thornton & Lilford, 1995), аналитический иерархический процесс (Dolan, 1990) и другие. Хорошо разработанный анализ принятия решения в сложной клинической ситуации может оказаться полезным при следовании клиническим рекомендациям (и, наверное, хорошо составленные клинические рекомендации должны включать хотя бы базовые основы КАПР). Не случайно, поэтому статья
G. Guyatt и соавт. (1999), озаглавленная «Как использовать рекомендации по лечению» включала большой раздел по КАПР и ее авторы считают, что успешное применение НДМ возможно только в случае интеграции с КАПР. D.Sackett и соавт. приводят упрощенную версию КАПР, которую может использовать любой, даже очень занятый клиницист (эта же методика описана в статье McAlister и соавт., 2000). Этот метод состоит из нескольких простых шагов1. Выявить предпочтения пациента. На этом этапе устанавливается, насколько высоко пациент ценит то, что он может приобрести в результате лечения и то, что может потерять. Для получения относительной ценности используется визуальная аналоговая шкала на которой 1 означает полное здоровье, а 0 – смерть.
2. Рассчитывается отношение вероятности пользы к вероятности вреда. Для этого клиницист может использовать NNT и количество лиц, которым лечение может повредить (NNH – величина, обратная разности частоты побочных эффектов в группе лечения и контроля) – тогда отношение будет равно NNH/NNT.
3. Умножить полученную величину на отношение ценностей приобретаемого в ходе лечения к теряемому в результате побочных эффектов. Полученная величина и позволяет принять решение о назначении препарата.
Небольшой пример, взятый из книги Sackett, позволяет прояснить методику. При исследовании применения интерферона для задержки прогрессирования рассеянного склероза (РС) было установлено, что частота прогрессирования в контрольной группе составляет 50%, а в группе лечения – 39% (NNT=9). Осложнения (гриппо-подобные симптомы и воспаление в месте укола) наблюдались в 37% случаев в контрольной группе и в 64% в группе лечения (NNH=4). Пациент, будучи снабжен информацией о тяжести прогрессирующей формы РС и побочных эффектах решил, что ценность состояния в развернутой форме РС составляет 0,05 (очень близко к состоянию «мертв»), а вот ценность состояния с побочными эффектами терапии составляет 0.95. Отношение этих двух величин составляет 19. Умножая эту величину на отношение NNH/NNT получаем 8.5:1 в пользу применения интерферона.
Если теперь предположить, что абсолютно такие же результаты были получены для лечения значительно более легкого заболевания (например, лечения головных болей) и пациент считает, что головная боль снижает качество его жизни на 0,2 отн. еденицы, то «ценность» этого состояния составляет 1-0,2=0,8. В этом случае отношение ценностей составит 1,2. Умножение полученной величины на отношение NNH/NNT даст 4/9*1.2=0,53 или 1 к 2 в пользу отказа от лечения. Таким образом в рамках НДМ можно интегрировать личные ценности и предпочтения пациента с данными, полученными в результате строгих научных исследований.
После завершения цикла работы с больным в рамках НДМ наступает этап оценки. На этом этапе клиницист оценивает свою работу с пациентами, свою способность сформулировать клинический вопрос, найти необходимые данные и внедрить их в практику. Как показывают результаты тех клиник, где эта методология внедряется, конечным эффектом является не уменьшение свободного времени врача в результате необходимости поиска дополнительных данных, а наоборот его высвобождение за счет активизации и оптимизации процесса диагностики и лечения.
Таким образом, НДМ, базирующаяся на достижениях современных информационных технологий и научных исследованиях становится все более и более важным инструментом в повышении эффективности и гуманизации медицины 21 века.
Литература
Sackett D.L., Straus S.S., Richardson W.S. Rosenberg W., Haynes R.B. Evidence-Based Medicine. How to practice and teach EBM. 2nd ed. Churchill Livingston, Edinburg, 2000.- 261 p.
Плавинская С.И., Шестов Д.Б., Плавинский С.Л., Хоптяр В.П. Роль общего холестерина плазмы крови и холестерина ЛПВП в прогнозе ИБС. // Кардиология.- 1997.- N 2.- c. 58-65
Garber A.M., Solomon N.A. Cost-effectiveness of alternative test strategies for the diagnosis of coronary artery disease//Ann.Int.Med.-v.130.-p.719-728
Zir L., Miller S., Dinsmore R., Gilbert J., Hawthorne J.W. Interobserver variability in coronary angiography// Circulation.- 1976.- v. 53.- p. 627-629
Eddy D. Variations in physician practice: the role of uncertainity.// Health Aff.-1984.-v. 3.-74-89
Eddy D. The challenge//JAMA.-1990.-v.263.- p. 287-290
Cohen J. Statistical power analysis for behavioral sciences. 2nd ed. Lawrence Erlbaum, Hillsdale,NJ, 1988
Laupacis A., Sackett D.L., Roberts R.S. An assessment of clinically useful measures of the consequences of treatment.// N.Engl.J.Med.-1988.- v. 319.- p. 1728-1733
Smeeth L., Haines A., Ebrahim S. Numbers needed to treat derived from meta-analysis – sometimes informative, usually misleading//Br. Med. J. – 1999.- v. 318.- p. 1548-1551
Guyatt G., Sinclair J., Cook D., Glaszion P. Users’ guide to the medical literature. XVI. How to use a treatment recommendation.//JAMA.-1999.-v.281.-p. 1836-1843
Thornton J, Lilford R. Management for Doctors: Decision analysis for medical managers// BMJ.- 1995.- v.310 .- p. 791-794
Dolan J. Can decision analysis adequately represent clinical problem?// J.Clin.Epidemiol. – 1990.- v.43.- p.277-284
McAlister F.A., Straus S.S., Guyatt G.H., Haynes B.R. User's guide to the medical literature. XX. Integrating research evidence with care of the individual patient//JAMA.-2000.-v.283.-p. 2829-2836